Química -
Um dos assuntos bastante abordados nos exames vestibulares do país são as propriedades coligativas. Sua aplicação está em um dos principais laboratórios de química que você conhece _a cozinha.
Recordando alguns conceitos importantes:
Observe o esquema:
Como as moléculas de água são polares e com as diferenças de eletronegatividade entre os átomos dos elementos oxigênio e hidrogênio estabelecem-se as pontes de hidrogênio.
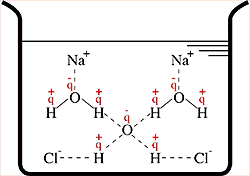
Quando adiciona-se o sal, ele sofre dissociação iônica, segundo a equação da reação:
![]()
Logo os cátions sódio e ânions cloreto são atraídos pelos átomos dos elementos oxigênio e hidrogênio, respectivamente.
Com isso ocorre o aumento do número de forças intermoleculares. Em função desse aumento será preciso mais energia para romper estas forças.
Institui-se então que as propriedades coligativas levam em conta todos os tipos de ligações, como por exemplo: iônica, covalente, covalente dativa, covalente polar, apolar, dipolo permanente, dipolo induzido e pontes de hidrogênio.
A partir das interações soluto-solvente (forças intermoleculares) haverá influência no comportamento da solução frente ao aquecimento, congelamento e quantidade de vapor do solvente produzido.
Veja o exemplo:
(ITA) Em relação à água pura, é de se esperar que uma solução de
10g de sacarose em 150 g de água tenha respectivamente:
| ponto de ebulição | ponto de solidificação | pressão de vapor | |
| a | menor | maior | menor |
| b | menor | menor | menor |
| c | maior | menor | menor |
| d | maior | menor | maior |
| e | nenhuma das respostas acima |
Explicação:
Na medida em que se adiciona um soluto a um solvente (açúcar em água) aumentam-se as forças intermoleculares, logo será preciso mais energia para o solvente entrar em ebulição.
Como houve o aumento de forças intermoleculares será preciso abaixar a temperatura para que as moléculas se agreguem no estado sólido.
Como o ponto de ebulição aumentou, a quantidade de vapor do solvente produzido será menor, logo exercerá menor pressão sobre o líquido. *Perseu Lúcio Alexander Helene de Paula é professor de química desde 1985.







ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.