Química -
O Cálculo Estequiométrico é um assunto muito abordado nos vestibulares. Vamos tentar entender:
Para fazermos um bolo simples é necessário respeitar uma receita padrão:
3 xícaras de farinha de trigo
4 ovos
1 copo de leite
É evidente que aqui não levaremos em conta o recheio. Este fica a critério do freguês.
Observe então:
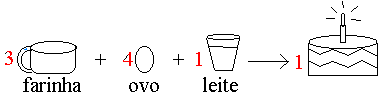
Podemos identificar que a receita nos traz os ingredientes e suas quantidades.
No Cálculo Estequiométrico, temos a mesma situação. Para resolvê-lo precisamos de uma receita (reação) que traga os ingredientes (reagentes e/ou produtos) e suas quantidades (coeficientes estequiométricos da reação).
Exemplo: | |
Por analogia, | 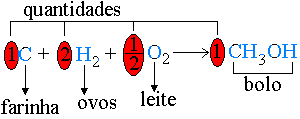 |
Devemos lembrar que as quantidades em uma reação não podem ser dadas em xícaras, copos e etc., mas em quantidade de matéria (mols). Assim a reação em exemplo estabelece uma proporção: | |
Para cada mol de carbono são necessários 2 mols de gás hidrogênio e meio mol de gás oxigênio. Se pusermos para reagir 2 mols de carbono, será necessário dobrar a receita. | |
Em tempo, a quantidade de matéria (mol) é equivalente à massa molar de uma substância ou então a 6,02 . 1023 moléculas e se for um gás que esteja nas condições normais de temperatura e pressão, o mol pode significar 22,4 litros. | |
*Perseu Lúcio Alexander Helene de Paula é professor de química desde 1985.








ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.