Semana 28 Química
ITA 2010
Foram realizadas duas experiências com dois ovos de galinha. Inicialmente, ambos foram imersos em vinagre até a dissolução total da casca, que pode ser considerada constituída prioritariamente por carbonato de cálcio. Os ovos envoltos apenas em suas membranas foram cuidadosamente retirados do vinagre e deixados secar por um breve período. A seguir, um ovo foi imerso em água pura e, o outro, numa solução saturada de sacarose, sendo ambos assim mantidos até se observar variação volumétrica de cada ovo.
a) Escreva a equação química balanceada que descreve a reação de dissolução da casca de ovo.
b) O volume dos ovos imersos nos líquidos deve aumentar ou diminuir? Explique sucintamente por que estas variações volumétricas ocorrem.
Resposta:
 |
Unicamp 2007
As plantas estocam suas reservas de açúcar como amido nas formas de amilose e amilopectina. A amilose é mais dificilmente transformada nos seus açúcares constituintes; consequentemente, alimentos ricos em amilose conduzem a um "índice glicêmico' mais baixo do que aqueles ricos em amilopectina. Por conta disso, pesquisadores têm desenvolvido grãos vegetais em que a relação entre as quantidades dessas duas formas de amido é diferente da que se verifica na planta original. O principal interesse dessas pesquisas diz respeito à melhoria da saúde humana pelo uso desses produtos como coadjuvantes no tratamento de certas doenças e no controle de peso corporal.
a) De acordo com o texto e com seus conhecimentos sobre ciências, dê o nome de uma doença cujo tratamento poderia utilizar os produtos resultantes dessas pesquisas.
b) Se você fosse fabricar um alimento indicado para pessoas que precisassem controlar o peso em valores baixos, que tipo de cereal você usaria preferencialmente: com alto ou baixo teor de amilopectina em relação à amilose?
c) Também de acordo com o texto, explique resumidamente o que é o "índice glicêmico".
Resposta:
a) Diabete.
b) O cereal usado preferencialmente deve apresentar baixo teor de amilopectina em relação à amilase.
c) Amido sofre hidrólise fornecendo glicose, segundo a equação química:
 |
O índice glicêmico é um fator que diferencia os carboidratos, ou seja, a forma como o carboidrato é digerido, absorvido e utilizado. Quanto maior o teor de açúcar glicose produzido, maior o índice glicêmico.
Unicamp 2009
O nadador Michael Phelps surgiu na Olimpíada de Beijing como um verdadeiro fenômeno, tanto pelo seu desempenho quanto pelo seu consumo alimentar. Divulgou-se que ele ingere uma quantidade diária de alimentos capaz de lhe oferecer uma energia de 50 MJ. Quanto disto é assimilado, ou não, é uma incógnita. Só no almoço, ele ingere um pacote de macarrão de 500 gramas, além de acompanhamentos.
a) Suponha que o macarrão seja constituído essencialmente de glicose (C6H12O6), e que, no metabolismo, toda essa glicose seja transformada em dióxido de carbono e água. Considerando-se apenas o metabolismo do macarrão diário, qual é a contribuição do nadador para o efeito estufa, em gramas de dióxido de carbono?
b) Qual é a quantidade de energia, em kJ, associada à combustão completa e total do macarrão (glicose) ingerido diariamente pelo nadador?
Dados de entalpia de formação em kJmol-1: glicose = -1.274, água = -242, dióxido de carbono = -394.
Resposta:
 |
Unicamp 2010
Na Revista n.163 relatam-se alguns aspectos da pesquisa brasileira do etanol de segunda geração que visa à obtenção desse importante combustível a partir do bagaço e da palha da cana-de-açúcar. A obtenção do álcool pode se dar pela hidrólise desses materiais em meio ácido. Num dos trechos afirma-se: enquanto o ácido sulfúrico destrói parte do açúcar formado, o ácido clorídrico, mais eficiente, tem um problema ligado à corrosividade, exigindo ligas de metal de custos elevados.
a) A destruição do açúcar, citada no texto, pode ser exemplificada pela reação da sacarose com ácido sulfúrico concentrado, representada simplificadamente pela equação química:
 |
onde n<11. Levando-se em conta o conhecimento químico e a equação química apresentada, que evidências experimentais poderiam sugerir que o exemplo dado é uma reação química?
b) Um tipo de corrosão química do aço se deve à presença do íon cloreto. Diferenças na composição do aço podem levar a diferenças na resistência à corrosão; quanto maior o valor de PRE (Pitting Resistance Equivalent), mais resistente é o aço. Com base nos dados da tabela abaixo, que aço você escolheria para construir um reator para a obtenção de etanol do bagaço da cana por hidrólise com ácido clorídrico? Justifique.
 |
Resposta:
 |
ITA 2011
Para cada conjunto de substâncias, escolha aquela que apresenta a propriedade indicada em cada caso. Justifique sua resposta.
a) Entre acetona, ácido acético e ácido benzóico, qual deve apresentar a maior entalpia de vaporização?
b) Entre hidrogênio, metano e monóxido de carbono, qual deve apresentar o menor ponto de congelamento?
c) Entre flúor, cloro e bromo, qual deve apresentar maior ponto de ebulição?
d) Entre acetona, água e etanol, qual deve apresentar menor pressão de vapor nas condições ambientes?
e) Entre éter, etanol e etilenoglicol, qual deve apresentar maior viscosidade nas condições ambientes?
Resposta:
 |
Unicamp 2008
Se o caso era cozinhar, Rango não tinha problemas. Ele preparou a massa do bolo da festa utilizando um fermento químico à base de carbonato ácido (bicarbonato) de sódio. Rango começou bem cedo essa preparação, pois Estrondosa vivia reclamando que depois que o gás passou a ser o gás de rua, parecia que o forno havia ficado mais lento para assar. Perdido nessas maravilhas que rodeavam a atividade na cozinha, Rango se refestelava com os conceitos químicos.
a) "Antes de usar o fermento, eu coloquei um pouco dele em água e houve um desprendimento de gás. Isso me indicou que o fermento estava adequado para ser utilizado no bolo. Qual é a equação química da reação que eu acabei de observar?"
b) "Se a reclamação de Estrondosa sobre o gás combustível for verdadeira, o gás liquefeito de petróleo (butano) deve fornecer uma energia maior que o gás de rua (metano), considerando-se uma mesma massa de gás queimado... Será que essa hipótese é verdadeira?"
Dados: entalpias de formação em kJ mol-1: butano = -126, metano = -75, gás carbônico = -394 e água = -242
Resposta:
 |
Fuvest 2009
Aminas primárias e secundárias reagem diferentemente com o ácido nitroso:
 |
a) A liberação de N2 (g), que se segue à adição de HNO2, permite identificar qual dos seguintes aminoácidos?
 |
Explique sua resposta.
Uma amostra de 1,78 g de certo α-aminoácido (Isto é, um aminoácido no qual o grupo amino esteja ligado ao carbono vizinho ao grupo -CO2H) foi tratada com HNO2, provocando a liberação de nitrogênio gasoso. O gás foi recolhido e, a 25oC e 1 atm, seu volume foi de 490 mL.
b) Utilizando tais dados experimentais, calcule a massa molar desse α-aminoácido, considerando que 1 mol de α-aminoácido produz 1 mol de nitrogênio gasoso.
c) Escreva a fórmula estrutural plana desse α-aminoácido, sabendo-se que, em sua estrutura, há um carbono assimétrico.
Dados:
a 25oC e 1 atm, volume molar = 24,5 L/mol;
massas molares (g/mol): H ....1; C ..... 12; N ...... 14; O ..... 16.
Resposta:
 |
Fuvest 2009
A reação de hidratação de alguns alcinos pode ser representada por
 |
em que R e R1 são dois grupos alquila diferentes.
a) Escreva as fórmulas estruturais dos isômeros de fórmula C6H10 que sejam hexinos de cadeia aberta e não ramificada.
b) A hidratação de um dos hexinos do item anterior produz duas cetonas diferentes, porém isoméricas. Escreva a fórmula estrutural desse Alcino e as fórmulas estruturais das cetonas assim formadas.
c) A hidratação do hex-3-ino (3-hexino) com água monodeuterada (HOD) pode ser representada por:
 |
Escreva as fórmulas estruturais de X, Y e Z. Não considere a existência de isomeria cis-trans.
Resposta:
 |
Unicamp 2010
Um estudo publicado na Revista n. 149 mostra pesquisas sobre a utilização da glicerina (um triol), um sub-produto da produção de biodiesel, para obtenção de polipropileno, um plástico amplamente utilizado. A motivação partiu deles e no início achei difícil retirar da glicerina (C3H8O3) os átomos de oxigênio para transformá-la em propeno (C3H6), lembra um pesquisador da Universidade federal do Rio de Janeiro (UFRJ).
a) levando em conta as estruturas das moléculas da glicerina e do propeno, explique por que uma dessas substâncias é gasosa e a outra é líquida em condições ambiente, evidenciando qual é a líquida e qual é a gasosa.
b) O texto da revista ainda informa: 540 kg de óleo a que são acrescentados 54 kg de metanol, resultam em 540 kg de biodiesel e 54 kg de glicerina. Essa glicerina vai resultar em 27 kg de propeno e posteriormente na mesma quantidade de polipropileno. Do ponto de vista rigorosamente estequiométrico e considerando a quantidade de glicerina obtida, a produção de propeno seria maior, menor ou igual à descrita no texto da revista. Justifique.
Resposta:
 |
ITA 2008
Uma amostra de um ácido dicarboxílico com 0,104 g de massa é neutralizada com 20 cm3 de uma solução aquosa 0,1 mol L-1 em NaOH. Qual das opções abaixo contém a fórmula química do ácido constituinte da amostra?
ITA 2009
Escreva a equação química balanceada da combustão completa do iso-octano com o ar atmosférico. Considere que o ar é seco e composto por 21% de oxigênio gasoso e 79% de nitrogênio gasoso.
Resposta:
O isooctano (2,2,4-trimetilpentano), sofrendo oxidação completa com O2 existente no ar atmosférico, fornece:
2C8H18 + 25O2 → 16CO2 + 18H2O Como no ar há N2, em alta temperatura, ele também reage com O2, formando óxidos de nitrogênio:
N2 + O2 → 2NO
ENEM 2010
No que tange à tecnologia de combustíveis alternativos, muitos especialistas em energia acreditam que os alcoóis vão crescer em importância em um futuro próximo. Realmente, alcoóis como metanol e etanol têm encontrado alguns nichos para uso doméstico como combustíveis há muitas décadas e, recentemente, vêm obtendo uma aceitação cada vez maior como aditivos, ou mesmo como substitutos para gasolina em veículos. Algumas das propriedades físicas desses combustíveis são mostradas no quadro seguinte.
 |
Dados: Massas molares em g/mol: H = 1,0; C = 12,0; O = 16,0.
Considere que, em pequenos volumes, o custo de produção de ambos os alcoóis seja o mesmo. Dessa forma, do ponto de vista econômico, é mais vantajoso utilizar
Fuvest 2011
Maçaricos são queimadores de gás utilizados para produzir chamas de elevadas temperaturas, como as requeridas para soldar metais. Um gás combustível, muito utilizado em maçaricos, é o acetileno, C2H2, sendo que a sua combustão pode ser promovida com ar atmosférico ou com oxigênio puro.
a) Escreva a equação química balanceada da combustão completa do acetileno com oxigênio puro.
b) Em uma oficina de solda, existem dois cilindros idênticos, um deles contendo oxigênio puro (cilindro A) e o outro, ar atmosférico (cilindro B). Sabendo que, no interior dos dois cilindros, as condições de pressão e temperatura são as mesmas, qual dos dois cilindros contém a maior massa gasosa? Explique.
c) A temperatura da chama do maçarico é maior quando se utiliza a mistura de oxigênio e acetileno do que quando se usa a mistura de ar atmosférico e acetileno, mesmo estando os reagentes em proporção estequiométrica nos dois casos. Considerando as substâncias gasosas que recebem o calor liberado na combustão, em cada caso, explique essa diferença de temperatura.
 |
Resposta:
 |
ITA 2011
A combustão de um composto X na presença de ar atmosférico ocorre com a formação de fuligem. Dos compostos abaixo, assinale a opção que contém o composto X que apresenta a maior tendência de combustão fuliginosa.
ITA 2011
Considere a energia liberada em
I. combustão completa (estequiométrica) do octano e em
II. célula de combustível de hidrogênio e oxigênio.
Assinale a opção que apresenta a razão CORRETA entre a quantidade de energia liberada por átomo de hidrogênio na combustão do octano e na célula de combustível.
Dados: Energias de ligação, em kJ mol-1:
 |
ITA 2011
Assinale a opção que apresenta o ácido mais forte, considerando que todos se encontram nas mesmas condições de concentração, temperatura e pressão.
Fuvest 2011
Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica:
 |
Nessa fórmula, os grupos R, R' e R' representam longas cadeias de carbono, com ou sem ligações duplas.
A partir dos óleos vegetais, pode-se preparar sabão ou biodiesel, por hidrólise alcalina ou transesterificação, respectivamente. Para preparar sabão, tratam-se os triglicerídeos com hidróxido de sódio aquoso e, para preparar biodiesel, com metanol ou etanol.
a) Escreva a equação química que representa a transformação de triglicerídeos em sabão.
b) Escreva uma equação química que representa a transformação de triglicerídeos em biodiesel.
Resposta:
 |
Unicamp 2009
Antes das provas de 100 e 200 metros rasos, viu-se, como prática comum, os competidores respirarem rápida e profundamente (hiperventilação) por cerca de meio minuto. Essa prática leva a uma remoção mais efetiva do gás carbônico dos pulmões imediatamente antes da corrida e ajuda a aliviar as tensões da prova. Fisiologicamente, isso faz o valor do pH sanguíneo se alterar, podendo chegar a valores de até 7,6.
a) Mostre com uma equação química e explique como a hiperventilação faz o valor do pH sanguíneo se alterar.
b) Durante esse tipo de corrida, os músculos do competidor produzem uma grande quantidade de ácido lático, CH3CH(OH)COOH, que é transferido para o plasma sanguíneo. Qual é a fórmula da espécie química predominante no equilíbrio ácido-base dessa substância no plasma, ao término da corrida? Justifique com cálculos.
Dados: Ka do ácido lático = 1,4 x 10-4. Considerar a concentração de H+ = 5,6 x 10-8 mol L-1 no plasma.
Resposta:
 |
Unicamp 2011
Em algumas construções antigas encontram-se paredes feitas de peças de mármore (CaCO3) juntadas umas às outras por uma "cola especial". Essa "cola especial" também pode se formar na produção de queijos no processo convencional. Se nas construções antigas a produção dessa "cola especial" foi proposital, na produção de queijos ela é indesejável e deve ser evitada, pois leva à formação de macrocristais na massa do queijo. Essa "cola especial" é o lactato de cálcio, que, no caso das construções, foi obtido a partir da reação da superfície do mármore com o ácido lático do soro do leite, enquanto que no caso do queijo ele se origina no processo de maturação do queijo a baixa temperatura.
a) Sabendo que a fórmula do ácido lático é CH3CHOHCOOH, e considerando as informações dadas, escreva a equação química da reação de formação da "cola especial" nas construções antigas.
b) Na fabricação de queijo Cheddar, pesquisas recentes sugerem que a adição de 1% em massa de gluconato de sódio é a quantidade ideal para se evitar a formação de macrocristais de lactato de cálcio. Considerando essa informação e os dados abaixo, explique por que não seria apropriado usar uma quantidade nem maior nem menor que 1% nesse processo.
Dados de solubilidade dos possíveis sólidos que podem se formar: lactato gluconato de cálcio = 52; lactato de cálcio = 9; gluconato de cálcio = 3. Valores em gramas de íon cálcio por litro de solução.
Resposta:
 |
Unicamp 2011
Xampus e condicionadores utilizam as propriedades químicas de surfatantes para aumentar a molhabilidade do cabelo. Um xampu típico utiliza um surfatante aniônico, como o lauril éter sulfato de sódio (A), que ajuda a remover a sujeira e os materiais oleosos dos cabelos. Um condicionador, por sua vez, utiliza um surfatante catiônico, como o cloreto de lauril trimetil amônio (B), que é depositado no cabelo e ajuda a diminuir a repulsão entre os fios limpos dos cabelos, facilitando o pentear.
 |
a) Considerando a estrutura do xampu típico apresentado, explique como ele funciona, do ponto de vista das interações intermoleculares, na remoção dos materiais oleosos.
b) Considerando-se as informações dadas e levando-se em conta a estrutura química desses dois surfatantes, a simples mistura dessas duas substâncias levaria a um "produto final ineficiente, que não limparia nem condicionaria". Justifique essa afirmação.
Resposta:
a) Os materiais oleosos são predominantemente apolares. Analisando a estrutura apresentada do xampu (A), verifica-se a presença de uma cadeia carbônica longa, de caráter apolar, que interage com o material oleoso. Na extremidade da cadeia, a parte iônica, de caráter polar, interage com a água, efetuando a remoção do material oleoso.
b) De acordo com as estruturas fornecidas, a mistura dos dois compostos promove a interação entre a parte catiônica de B e a parte aniônica de A, havendo a neutralização das cargas elétricas. Desta forma, ocorre a formação de um sal que, por ser pouco solúvel em água, tem sua remoção dificultada, o que leva a um produto final ineficiente, pois a nova estrutura não apresenta as características de um agente surfatante.
ITA 2008
O explosivo plástico conhecido como PBX é constituído de uma parte polimérica, normalmente poliuretano. A formação do poliuretano é atribuída à reação entre um poliol com
ITA 2010
Considere que as reações químicas apresentadas pelas equações balanceadas abaixo ocorram em condições experimentais apropriadas e que as espécies A, B, C, D, e F representem os produtos destas reações.
C6H6 OCH3 + HI → A + B
CH3 CH2 I + Na → C + D
CH3 CH2 I + CH3 CH2 C ≡ C Na → E + F
Apresente as equações químicas balanceadas e os respectivos produtos.
Resposta:
 |
ITA 2010
Considere o composto aromático do tipo C6H5Y, em que Y representa um grupo funcional ligado ao anel.
Assinale a opção ERRADA com relação ao(s) produto(s) preferencialmente formado(s) durante a reação de nitração deste tipo de composto nas condições experimentais apropriadas.
ITA 2011
Assinale a opção que apresenta a ordem crescente ERRADA de solubilidade em água das substâncias abaixo, nas condições ambientes.
Fuvest 2010
Na dupla hélice do DNA, as duas cadeias de nucleotídeos são mantidas unidas por ligações de hidrogênio entre as bases nitrogenadas de cada cadeia. Duas dessas bases são a citosina (C) e a guanina (G).
 |
a) Mostre a fórmula estrutural do par C-G, indicando claramente as ligações de hidrogênio que nele existem.
No nosso organismo, a síntese das proteínas é comandada pelo RNA mensageiro, em cuja estrutura estão presentes as bases uracila (U), citosina (C), adenina (A) e guanina (G).
A ordem em que aminoácidos se ligam para formar uma proteína é definida por tríades de bases, presentes no RNA mensageiro, cada uma correspondendo a um determinado aminoácido. Algumas dessas tríades, com os aminoácidos correspondentes, estão representadas na tabela da folha de respostas. Assim, por exemplo, a tríade GUU corresponde ao aminoácido valina.
Letra da esquerda: G Letra do meio: U Letra da direita: U
b) Com base na tabela da folha de respostas e na estrutura dos aminoácidos aqui apresentados, mostre a fórmula estrutural do tripeptídeo, cuja sequência de aminoácidos foi definida pela ordem das tríades do RNA mensageiro, que era GCA, GGA, GGU. O primeiro aminoácido desse tripeptídeo mantém livre seu grupo amino.
 |
Resposta:
 |
Fuvest 2011
Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica:
 |
Nessa fórmula, os grupos R, R' e R'' representam longas cadeias de carbono, com ou sem ligações duplas.
A partir dos óleos vegetais, pode-se preparar sabão ou biodiesel, por hidrólise alcalina ou transesterificação, respectivamente. Para preparar sabão, tratam-se os triglicerídeos com hidróxido de sódio aquoso e, para preparar biodiesel, com metanol ou etanol.
a) Escreva a equação química que representa a transformação de triglicerídeos em sabão.
b) Escreva uma equação química que representa a transformação de triglicerídeos em biodiesel.
Resposta:
 |
Fuvest 2011
Recentemente, foi preparado um composto A que é insolúvel em água. No entanto, quando misturado com água saturada de gás carbônico, forma-se uma solução que contém o íon B. Quando a solução resultante é aquecida, o gás carbônico é eliminado, e se formam duas camadas, uma de água e outra de composto A. Essas transformações reversíveis podem ser representadas pela seguinte equação química:
 |
O composto A está sendo testado em um novo processo de extração do óleo de soja. No processo atual, utiliza-se hexano para extrair o óleo dos flocos de soja, formando uma solução. Em seguida, o hexano é separado do óleo de soja por destilação.
O novo processo, utilizando o composto A em vez de hexano, pode ser representado pelo seguinte esquema:
 |
a) Descreva o que deve ser feito nas etapas X e Y para se obter o resultado mostrado no esquema.
b) Explique por que, no processo de extração do óleo de soja, é vantajoso evitar a destilação do solvente hexano.
Resposta:
a) Na etapa X, foi adicionada água saturada de CO2. Podemos verificar, pelo esquema, que flocos de soja foram extraídos com o composto A, formando uma solução (mistura homogênea) e, com a adição de água saturada de CO2 (etapa X), o equilíbrio da reação citada é deslocado para a direita, formando íons solúveis em água e que não se misturam com o óleo, o que configura um sistema bifásico.
Na etapa Y, o sistema foi aquecido, provocando o desprendimento de CO2.
A solução de B (íons) com água saturada de CO2, sendo aquecida (etapa Y), desloca o equilíbrio da reação para a esquerda, eliminando o CO2 e formando a substância A insolúvel em água (sistema bifásico).
b) No processo de destilação do solvente hexano, energia é consumida para provocar a vaporização do hexano.
Algumas desvantagens desse processo em relação ao novo sugerido podem ser: maior consumo de energia, presença de traços de hexano no óleo de soja, emissão de solvente volátil tóxico para o ar (contribui para o efeito estufa, para o smog fotoquímico e é cancerígeno).
No processo sugerido, toda substância A é reaproveitada (evitando perda de material), obedecendo de forma mais adequada à química verde.
ITA 2011
A reação catalisada do triacilglicerol com um álcool (metanol ou etanol) produz glicerol (1,2,3-propanotriol) e uma mistura de ésteres alquílicos de ácidos graxos de cadeia longa, mais conhecido como biodiesel. Essa reação de transesterificação envolve o equilíbrio representado pela seguinte equação química balanceada:
 |
em que R', R'', R''' = cadeias carbônicas dos ácidos graxos e R = grupo aquil do álcool reagente
A respeito da produção do biodiesel pelo processo de transesterificação, são feitas as seguintes afirmações:
I. O hidróxido de sódio é dissolvido completamente e reage com o agente transesterificante para produzir água e o íon alcóxido.
II. Na transesterificação catalisada por álcali, os reagentes empregados nesse processo devem ser substancialmente anidros para prevenir a formação de sabões.
III. Na reação de produção do biodiesel pela rota etílica, com catalisador alcalino, o alcóxido formado inibe a reação de saponificação.
Das afirmações acima, está(ão) CORRETA (S) apenas
Fuvest 2008
Foram misturados 2,00 L de um alcano de m átomos de carbono por molécula e 2,00 L de outro alcano de n átomos de carbono por molécula, ambos gasosos. Esses alcanos podem ser quaisquer dois dentre os seguintes: metano, etano, propano ou butano. Na combustão completa dessa mistura gasosa, foram consumidos 23,00 L de oxigênio. Todos os volumes foram medidos nas mesmas condições de pressão e temperatura.
a) Escreva a equação da combustão completa de um alcano de n átomos de carbono por molécula.
Para identificar os dois alcanos que foram misturados, conforme indicado acima, é preciso considerar a lei de Avogadro, que relaciona o volume de um gás com seu número de moléculas.
b) Escreva o enunciado dessa lei.
c) Identifique os dois alcanos. Explique como chegou a essa conclusão.
Resposta:
 |
Fuvest 2009
A aparelhagem, representada na figura, permite produzir acetileno (etino), a partir de carbeto de cálcio (CaC2), por reação com água, utilizando-se, em seguida, o acetileno para produzir benzeno. Essa última reação ocorre usando-se ferro como catalisador, sob aquecimento.
 |
a) A primeira etapa desse processo consiste na reação de carbeto de cálcio com água. Escreva a equação química balanceada que representa essa transformação.
b) A segunda etapa desse processo consiste na transformação catalisada de acetileno em benzeno. Escreva a equação química balanceada dessa reação.
c) Para a produção de benzeno, a partir de carbeto de cálcio, utilizando a aparelhagem acima, que substâncias devem ser colocadas, quais se formam ou são recolhidas nas partes A, B, C, D e E da figura? Responda, preenchendo a tabela da folha de respostas.
Dados: estados físicos nas condições ambientes
acetileno ............................ gás
benzeno ............................. líquido
 |
Resposta:
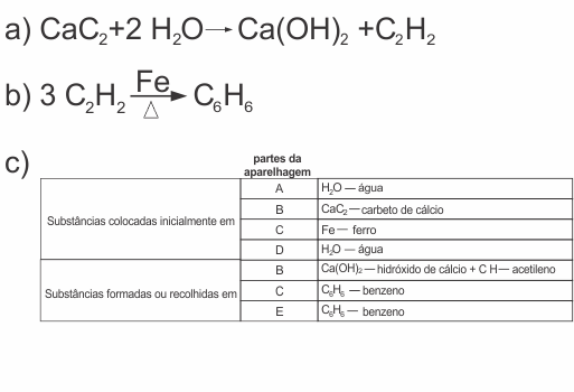 |
ITA 2008
Apresente as respectivas fórmulas químicas estruturais das espécies químicas (A, B, C, D, E) presentes nas seguintes equações químicas:
 |
Resposta:
 |
ITA 2009
Escreva a equação química balanceada da combustão completa do iso-octano com o ar atmosférico. Considere que o ar é seco e composto por 21% de oxigênio gasoso e 79% de nitrogênio gasoso.
Resposta:
 |
ITA 2009
Foi observada a reação entre um composto X e uma solução aquosa de permanganato de potássio, a quente, ocorrendo o aumento do pH da solução e a formação de um composto Y sólido. Após a separação do composto Y e a neutralização da solução resultante, verificou-se a formação de um composto Z pouco solúvel em água. Assinale a opção que melhor representa o grupo funcional do composto orgânico X.
Fuvest 2008 - 2a fase
Foram misturados 2,00 L de um alcano de m átomos de carbono por molécula e 2,00 L de outro alcano de n átomos de carbono por molécula, ambos gasosos. Esses alcanos podem ser quaisquer dois dentre os seguintes: metano, etano, propano ou butano. Na combustão completa dessa mistura gasosa, foram consumidos 23,00 L de oxigênio. Todos os volumes foram medidos nas mesmas condições de pressão e temperatura.
a) Escreva a equação da combustão completa de um alcano de n átomos de carbono por molécula.
Para identificar os dois alcanos que foram misturados, conforme indicado acima, é preciso considerar a lei de Avogadro, que relaciona o volume de um gás com seu número de moléculas.
b) Escreva o enunciado dessa lei.
c) Identifique os dois alcanos. Explique como chegou a essa conclusão.
Resposta:
 |
Fuvest 2008 - 2a fase
Foram misturados 2,00 L de um alcano de m átomos de carbono por molécula e 2,00 L de outro alcano de n átomos de carbono por molécula, ambos gasosos. Esses alcanos podem ser quaisquer dois dentre os seguintes: metano, etano, propano ou butano. Na combustão completa dessa mistura gasosa, foram consumidos 23,00 L de oxigênio. Todos os volumes foram medidos nas mesmas condições de pressão e temperatura.
a) Escreva a equação da combustão completa de um alcano de n átomos de carbono por molécula. Para identificar os dois alcanos que foram misturados, conforme indicado acima, é preciso considerar a lei de Avogadro, que relaciona o volume de um gás com seu número de moléculas.
b) Escreva o enunciado dessa lei.
c) Identifique os dois alcanos. Explique como chegou a essa conclusão.
Resposta:
 |
Fuvest 2007 - 2a fase
Ésteres podem ser preparados pela reação de ácidos carboxílicos ou cloretos de ácido, com alcoóis, conforme exemplificado:
 |
Recentemente, dois poliésteres biodegradáveis (I e II) foram preparados, utilizando, em cada caso, um dos métodos citados.
 |
a) Escreva a fórmula mínima da unidade estrutural que se repete n vezes no polímero I.
Dentre os seguintes compostos,
 |
quais são os reagentes apropriados para a preparação de
b) I?
c) II?
Resposta:
 |
Unicamp 2010 - 1a fase
Com a finalidade de manter uma imagem jovem, muitas pessoas procuram eliminar as rugas do rosto utilizando a quimioesfoliação (peeling químico), um processo que envolve algum risco à saúde. A quimioesfoliação consiste na aplicação de um ou mais agentes à pele, visando promover a esfoliação cutânea, o que leva à renovação celular e à eliminação das rugas. Dois tipos de peeling podem ser realizados: o superficial ou médio e o profundo.
a) Para um peeling superficial ou médio, costuma-se usar uma solução da substância indicada abaixo:
 |
Simplificadamente, a literatura afirma que, além da concentração da solução, o valor de pH ideal para uma boa esfoliação deve estar abaixo de sete. Considerando somente a dissolução dessa substância em água, seria possível obter essa condição de pH? Explique e justifique com uma equação química pertinente.
b) Para um peeling químico profundo, pode-se usar uma microemulsão denominada solução de Baker-Gordon, que contém a substância cuja fórmula estrutural está representada ao lado. Do ponto de vista da representação química, o hexágono com o círculo representa as possíveis estruturas ressonantes da cadeia carbônica. Desenhe essas possíveis estruturas ressonantes para a cadeia e escreva a fórmula molecular da substância.
 |
Resposta:
 |
